葡萄糖是最丰富的单糖,是一种必需的能量作为生命所有的领域细胞的来源,也是生物制药行业。植物生物质糖路线主导当前葡萄糖供应,同时二氧化碳直接转化为葡萄糖光合作用尚未得到很好的研究。在这里,我们展示了用于光合葡萄糖生产的细长聚球藻PCC 7942能够最终靠阻止天然葡萄糖激酶活性来解锁。击倒两人葡萄糖激酶基因导致葡萄糖在细胞内积聚,并促进基因组中自发突变的形成,最后导致葡萄糖分泌。无异源催化或运输基因、葡萄糖激酶缺乏和自发基因组突变导致葡萄糖分泌量为1.5g/L,通过以下方式进一步增加到5g/L代谢和培养工程。这些发现强调了蓝藻代谢可塑性及其在支撑中的应用葡萄糖的直接光合生产。
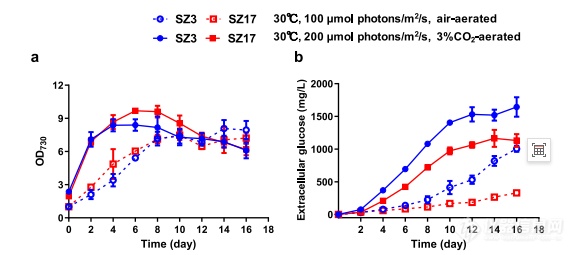
葡萄糖激酶缺乏菌株的细胞生长和葡萄糖分泌。葡萄糖激酶缺乏的细胞密度(a)和细胞外葡萄糖浓度(b)对菌株SZ3和SZ17进行了测量和比较。SZ3和SZ17在两种不同光照强度的条件下培养碳供应。空符号和虚线表示来自的文件培养条件为30°C,100µmol光子/m2/s和充气;和固体符号和实线°C培养条件下的文件,200µmol光子/m2/s和3%的CO2充气。数据以平均值±SD(n=3个生物重复)。光合放氧速率和呼吸速率收集聚球藻细胞,用17毫升新鲜的BG11的初始OD730
约为2.0。呼吸速率在30°C的黑暗中测量200秒,并测量整个链在160秒内测量了光合放氧速率每个光级(RGB源)10mM碳酸氢钠。总光合放氧速率为计算为净光合速率加上呼吸速率。

强光和高温的结合会损害光合作用(HLHT)压力。获得耐HLHT的光自养生物是费力的耗时,在大多数情况下是潜在的分子机制尚不清楚。在这里,我们增加了蓝藻的突变率长聚球菌PCC 7942通过遗传机制与栽培的组合扰动环境。利用高突变系统,我们分离出聚球藻具有改善的HLHT耐受性的突变体,并鉴定导致HLHT的基因组突变适应过程。位于莽草酸激酶编码基因的上游非编码区导致该基因的表达增强。莽草酸激酶的过表达聚球藻和聚囊藻中的编码基因导致改善HLHT耐受性。转录组分析表明,突变重塑聚球藻的光合链和代谢网络。因此,由高突变系统鉴定的突变可用于工程蓝藻对HLHT的耐受性得到改善。
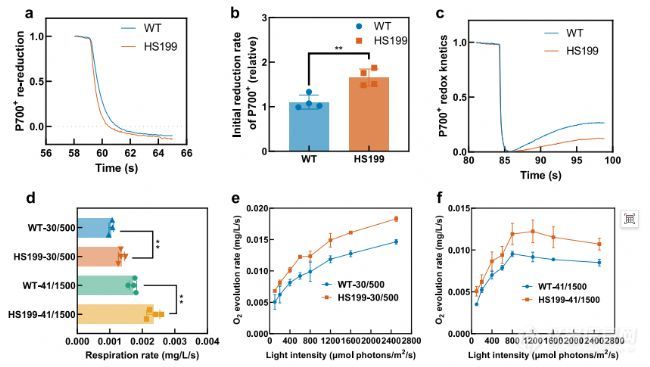
WT和HS199的光合生理参数。a–c WT和将HS199细胞悬浮在含有20μM DCMU的BG11中,并进行黑暗驯化测量前20分钟。P700被FR光氧化40秒监测随后在黑暗中P700+的再减少。曲线秒的最大吸光度进行归一化轻到一(a)。P700
+再减率的初始值是通过归一化得到的通过计算FR关闭后初始值的斜率和R2大于0.99(b)。AL终止后监测P700氧化还原FR光背景下的照明。P700水平通过以下标准化将AL照射终止后的吸光度最小值等于0并将AL照射终止前3s的吸光度最大值等于一(c)。d WT和HS199在30°C和500μmol下的呼吸速率,光子/m2/s(30/500)和41°C和1500μmol光子/m2/s(41/1500)。(氧气1L电池在黑暗中每秒消耗1OD730)。e、 f全链氧气WT和HS199在30°C和500μmol光子/m2下的演化/s(30/500)(e)41°C和1500μmol光子/m2/s(41/1500)(f)。(总析氧量在不同光照条件下,1L细胞每秒消耗1OD730)。每个实验被重复了两次以上,以确保其可靠性。a、c中的数据是以4个生物重复的平均值表示,b-e中的数据表示作为平均值±SD。样本量n(生物重复)为4、4、3和3英寸b、 d–f,但WT-30/500在d中的n为3。进行了统计分析使用双侧非配对Student t检验(**p0.01)。b中的p值为0.0042。p值在d中为0.0045和0.0017(从上到下)。
<

为了实现高效和低成本的微藻收获,对收获效率进行了调查以及利用真菌孢子辅助收获两种策略对小球藻HQ的潜在机制(FSH)和真菌颗粒辅助收获(FPH)。从生活垃圾污水中分离出的19种线种能形成颗粒,黑曲霉HW8-1的收获效率最高,为99.17%FPH和FSH的阳性率分别为88.70%。FSH在真菌藻类颗粒中的脂质和多糖含量是其2-3倍与FPH相比,它产生了更丰富的饱和脂肪酸和单不饱和脂肪酸。
以上为小球藻HQ和真菌藻丸在FSH和FPH中的生物量、呼吸和光合速率(微藻:小球藻HQ,线)
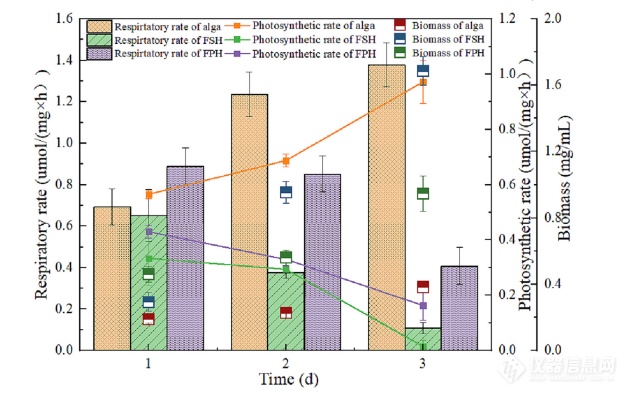
之前的研究已经描述了藻类真菌的气体相互运输颗粒,真菌呼吸为光合作用提供二氧化碳微藻,进而为真菌提供氧气(Leng等人,2021)。黑暗条件下DO速率的降低代表了呼吸速率微生物系统的降解率和光照条件下DO的降低率由于藻类细胞进行光合作用以产生氧气,因此速度减慢溶解在水中(Foladori等人,2018)。呼吸FPH率在培养的第一天最高,其次是藻类悬浮液和FSH。跟着时间的推移,藻类的呼吸速率细胞增加,而FSH和FPH细胞减少,原因是真菌的加入加速了营养的东西的消耗培养基转化为生物质,营养供应不足(Foladori等人,2018)。同样,光合作用FSH和FPH系统中的微藻减少,原因是菌丝体在颗粒形成过程中包裹在藻类细胞周围,这影响了光透射。FPH的光合速率为高于FSH,因为微藻在颗粒外FSH藻类细胞在里面。FSH和FPH收获机制的比较揭示由于以下原因,FPH的电荷中和(12小时)比FSH(72小时)更快产生带负电荷的EPS的真菌颗粒的分泌,其S-EPS含量是FPH的三倍(453.90 mg/mL)与FSH(146.30 mg/mL)相比蛋白质样官能团。此外,藻类真菌的光合作用通过FPH形成的颗粒更高,有助于改善氧气真菌-藻类系统的补给。

黄酮类化合物是植物中常见的天然多酚类化合物,已被提出具有高效和安全的杀藻剂。然而,ffavonoids抑制铜绿微囊藻的分子机制尚不清楚。本研究旨在探索蓝藻的全球转录变化和分子对接细胞对ffavonoids的反应。转录组学分析显示,5,4′-二羟基ffavone(DHF)主要影响铁和锌离子转运的基因转录,铁(III)和锌(II)最后导致细胞内铁和锌含量的降低。5,4′-DHF也能够最终靠与金属离子转运相关蛋白结合来干扰铁和锌的转运,导致消除铜绿假单胞菌的生物活性。同时,5,4′-DHF抑制微囊藻毒素的合成,降低其含量通过抑制mcyC的转录和与mcyC蛋白的结合来抑制细胞间毒素,这在某种程度上预示着5,4′-DHF具有降低环境中微囊藻毒素风险的潜力。光合作用相关基因转录的调控导致光合作用中电子传递的抑制系统。这些结果为ffavonoids的抑制机制提供了更多信息ffavonoids对金属离子跨膜转运的抑制为开发提供了新的视角化感物质杀藻剂。
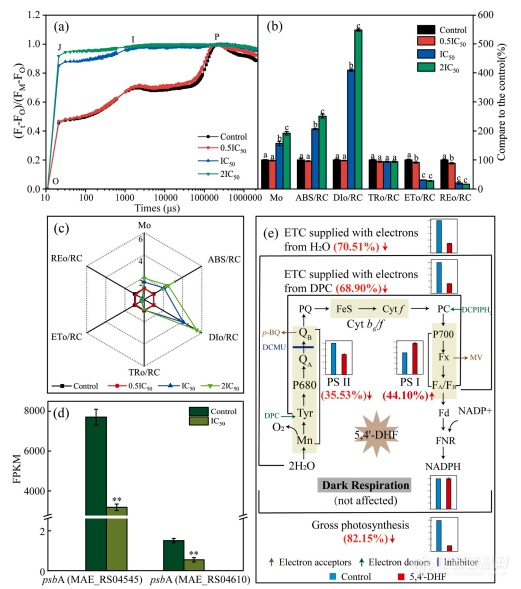
5,4′-DHF对铜绿假单胞菌光合系统的影响。(a) 用FO和FM归一化的Chl a扩散动力学为Vt=(Ft-FO)/(FM-FO)不同浓度5,4′-DHF处理铜绿假单胞菌的对数时间尺度。(b) 不同浓度下铜绿假单胞菌的JIP检验测试参数以对照的百分比表示的5,4′-DHF。(c) JIP参数的雷达图。(d) 相关基因的标准化转录丰度(FPKM)用5,4′-DHF的IC50浓度处理铜绿假单胞菌的光合系统。psbA(MAE_RS04545)和psbA(MABE_RS04610)编码光系统II D1蛋白质。(e) 蓝藻细胞光合电子传递的示意图,显示了5,4′-DHF对光合作用电子传递的影响经过测量O2的释放/消耗速率。条形图结果为了O2释放/消耗率占对照的百分比。红色箭头表示5,4′-DHF对相应部位的抑制率/促进率。它还显示了人工电子供体、受体和抑制剂的作用位点在本研究中使用。不同的字母表示从单因素方差分析中获得的p
本文介绍了用5,4′-DHF处理的铜绿假单胞菌。荧光在FO(50μs)和FM(P峰)之间对曲线进行归一化,并给出作为相对变量,扩散光谱Vt=(Ft-FO)/(FM-FO)对数时间刻度,显示OJIP曲线的更多信息。与对照组相比,除了5,4′-DHF的IC50为0.5×5,4′-DHF的OJIP曲线′-DHF导致J阶跃迅速增加,IP相消失。在5,4′-DHF的2×IC50,J步接近P步的水平控制。在这项研究中,MO、ABC/RC、DIO/RC、TRO/RC、ETO/RC和REO/选择RC来反映单元反应的电子和能量转移中心(RC)。铜绿假单胞菌的MO显著在5,4′-DHF的IC50和2×IC50下促进与对照组相比分别为56.77%和91.82%(p
0.05)。dio/rc在5,4′-dhf的ic50和2×ic50分别增加了309.17%和447.21%与对照组相比(p
<0.05)。与the相比对照组,铜绿假单胞菌的eto/rc在5,4′-dhf胁迫的ic50、ic50和2×ic50分别降低了8.49%,分别为69.19%和71.90%(p
<0.05)。此外,区域选举事务处抑制率分别为11.5%、79.34%和83.37%(p
<0.05)。5,4′-dhf对小鼠的tro/rc没有显著影响铜绿假单胞菌。为了确定5,4′-dhf在水稻光合作用中的靶位点铜绿假单胞菌,光合放氧,暗呼吸,电子输运活性用人工电子法测定供体、受体和抑制剂。在5,4′-dhf暴露5天后,暗呼吸速率差异不显著,总光合速率明显抑制率为82.15%(p
<0.01)。全电子的活性h2o和dpc向mv的转运显著减少分别为70.51%和68.90%(p
<0.01)。5,4′-dhf的psii活性治疗组显著降低35.53%(p
<0.01),但psi活性显著提高44.10%(p
<0.01)。
<
<

有害的蓝藻水华(HCBs)对全球生态构成威胁。紫外线 nm是一种有前景的控制蓝藻增殖的方法,但生长抑制是暂时的。UVC应用的复苏仍然是一个挑战,需要采取替代策略为了达到致命的效果。在这里,我们展示了使用紫外线A(UVA)对铜绿微囊藻的协同抑制作用UVC前的预照射。我们得知低剂量UVA预照射(1.5 J cm
-2)结合紫外线)与单独使用UVC相比,可减少85%的细胞密度(0.085 J cm-2)和触发器mazeEF介导的调节性细胞死亡(RCD)导致细胞裂解,而高剂量UVA预照射(7.5和14.7J cm-2)细胞密度增加75-155%。我们的析氧测试和转录组分析表明,UVA预照射会损害光系统I(PSI),当与UVC诱导的PSII损伤相结合协同抑制光合作用。然而,更高的UVA剂量激活SOS反应,促进UVC诱导的DNA损伤的修复。本研究强调了UVA预照射对蓝藻UVC抑制的影响,并提出了改进六氯代苯控制的实用策略。
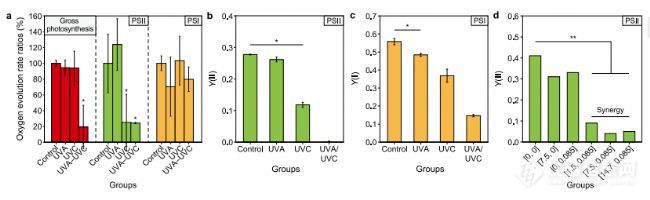
UVA和UVC连续照射引起的协同光合损伤。a、 UVA和UVC照射后2小时藻类溶液的析氧速率。氧气在800 mmol光子cm
-1下测量了演化速率表示为(照射组/对照组)%。bec,PSII(b)和PSI(c)的有效量子产率在紫外线小时,使用双PAM测量铜绿微囊藻细胞。d、 紫外线小时铜绿假单胞菌细胞PSII的有效量子产率为使用PHYTO-PAM测量。UVA和UVC分别独立地靶向PSI和PSII。UVA和UVC的连续照射阻断了所有电子传递链。In图a、b和c中,UVA和UVC的剂量分别为7.5和0.085 J cm-2分别。星号表示在p0.05时与*有显著差异,在p0.01时与**有显著差异。错误栏代表三个生物重复的标准偏差。
<0.01),然后迅速恢复到对照水平2天内,表明uva对铜绿假单胞菌细胞的光合作用。所有uva的y(ii)值/uvc组在0.1天内急剧降至0.1以下并且协同低于单uvc和uva组。此外,uva预照射后再进行uvc照射导致了显著的整个光合作用的etc率下降80%装置。潜伏期,所有uva/uvc组的y(ii)值从第5天开始恢复,模式与单uvc相似集团。具体来说,uva剂量较小(1.5 j cm







